UDCA
niezwykły kwas
Polecamy wykład
Infekcja SARS-CoV2 a wątroba,
dr hab. n. med. Michał Kukla
UDCA - informacje ogólne
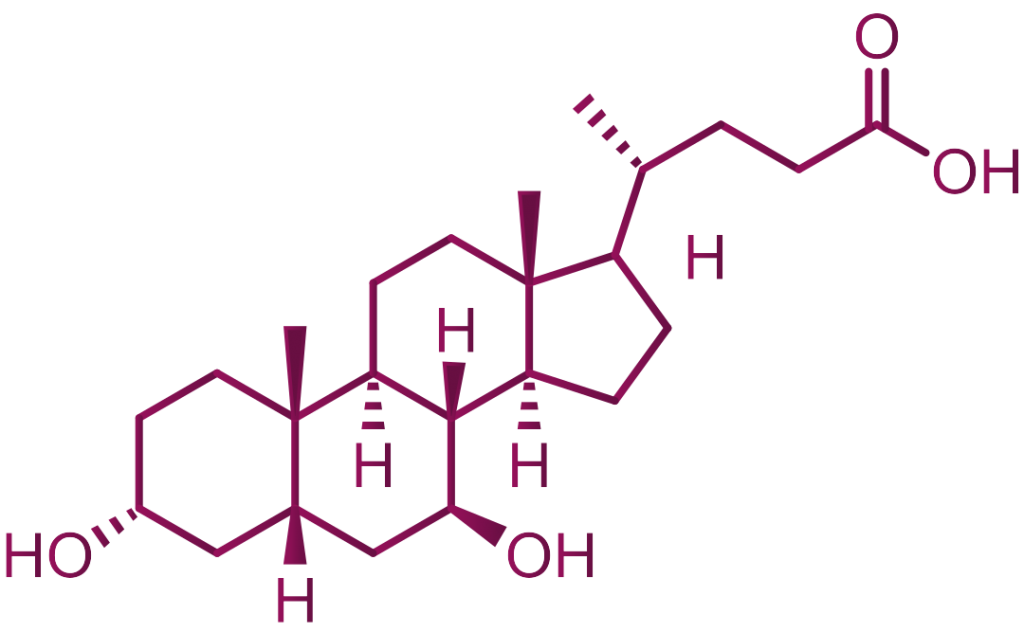
UDCA – kwas ursodeoksycholowy (kwas 3α, 7β-dihydroksy-5β-cholanowy) jest zaliczany do trzeciorzędowych kwasów żółciowych
UDCA jest obecny fizjologicznie w żółci człowieka, stanowiąc 1–3% puli kwasów żółciowych (Marin i wsp. 2015).
UDCA jest najbardziej hydrofilnym i tym samym najmniej toksycznym ze wszystkich kwasów żółciowych.
W warunkach fizjologicznych większość UDCA jest sprzężona z glicyną, która jest preferowanym szlakiem amidacji u ludzi (Hofmann 2009).
Po podaży doustnej pasywnie wchłania się w jelicie cienkim i grubym do krwiobiegu, z którego jest wychwytywany w wątrobie i wydzielany do żółci, wchodząc w fizjologiczny obieg kwasów żółciowych (wątrobowo-jelitowy obieg kwasów żółciowych). Do krwiobiegu przechodzi 30–60% przyjętej doustnie dawki. W wątrobie odbywa się sprzężenie UDCA z tauryną lub glicyną i w formie skoniugowanej wydzielenie poprzez drogi żółciowe do jelit, gdzie dochodzi do jego ponownej reabsorpcji. Powoduje to „wyparcie” endogennych kwasów żółciowych i zmianę procentowego składu żółci, którego UDCA staje się istotnym składnikiem. Doustne podawanie UDCA jest w stanie wzbogacić pulę kwasów żółciowych tym hydrofilowym kwasem żółciowym do 40% (Dilger i wsp. 2012), co jest uważane za zmniejszenie hydrofobowości puli kwasów żółciowych, a zatem zmniejszenie działania hepatotoksycznego w przypadku cholestazy.
Wielokierunkowy mechanizm działania UDCA
UDCA wywiera swoje korzystne działanie głównie na poziomie hepatocytów i cholangiocytów. Indukowane przez UDCA zmiany sygnalizacyjne w hepatocytach, modulujące odpowiednie szlaki wydzielania wątrobowo-żółciowego, działanie antyoksydacyjne oraz antyapoptotyczne leżą u podstaw hepatoprotekcyjnego działania UDCA (Beuers i wsp. 2015). Z jego działaniem są powiązane dodatkowe efekty na poziomie jelitowym, ponieważ amidowane formy UDCA hamują wchłanianie endogennych kwasów żółciowych w jelitach (Lanzini i wsp. 2003).
Stałe przyjmowanie kwasu ursodeoksycholowego w dawkach terapeutycznych powoduje, że staje się on głównym kwasem żółciowym, stanowiąc 40–60% ogólnej puli.
Na poziomie hepatocytów UDCA stymuluje przepływ żółci, a także wydzielanie anionów organicznych (Beuers 2006). Wczesne badania wykazały, że UDCA indukował większe natężenie przepływu i wyższe całkowite wydzielanie soli żółciowych. Wpływ UDCA na ekspresję białek transportujących w wątrobie in vivo jest raczej niewielki, podkreśla się znaczenie potranskrypcyjnych efektów UDCA jako odpowiedzialnych za niektóre z jego korzystnych skutków dla wątroby (Fickert i wsp. 2001).
Aktywność przeciwapoptotyczną
Inny ważny mechanizm, dzięki któremu UDCA działa hepatoprotekcyjnie, jest związany z jego aktywnością przeciwapoptotyczną. Toksyczność komórkowa hydrofobowych kwasów żółciowych jest częściowo związana z indukcją apoptozy, natomiast wykazano, że UDCA hamuje klasyczne szlaki apoptozy (Amaral i wsp. 2009). UDCA może znieść typowe zmiany morfologiczne jąder apoptotycznych, takie jak fragmentacja skondensowanej chromatyny jądrowej. Wykazano również, że UDCA hamuje indukcję apoptozy wywołaną przez etanol, TGF-β1, ligandy FAS i kwas okadaikowy (silny bodziec apoptotyczny), co sugeruje szerokie działanie przeciwapoptotycznego UDCA (Amaral i wsp. 2009).
Dodatkowe doniesienia wykazały, że UDCA znacząco zmniejsza mitochondrialne uwalnianie cytochromu C do komórek cytoplazmy, w komórkach wątroby traktowanych hydrofobowym kwasem żółciowym przez hamowanie zarówno aktywności tworzenia kanałów, jak i depolaryzacji błony mitochondrialnej (Rodrigues i wsp. 1999). Odkrycia te potwierdzają koncepcję, że UDCA może modulować próg apoptozy poprzez swoją ochronną rolę w błonie mitochondrialnej (Rodrigues i wsp. 1998). UDCA aktywuje szlaki przeżycia hepatocytu, takie jak p38, ERK, MAPK i PI3K (Schoemaker i wsp. 2004). Opisano również, że UDCA osłabia stres retikulum endoplazmatycznego, działając jak chaperon komórkowy – białko ochronne (Ozcan i wsp. 2006), co może również tłumaczyć jego działanie przeciwapoptotyczne.
Warto zauważyć, że właściwości antyapoptotyczne UDCA i jego koniugatu z tauryną TUDCA zostały wykazane także w innych typach komórek, zwłaszcza w neuronach (Abdelkader i wsp.2016). Jest to obecnie badane w niektórych przypadkach chorób neurodegeneracyjnych, takich jak choroba Parkinsona i stwardnienie zanikowe boczne (Vang i wsp. 2014; Abdelkader i wsp. 2016; Elia i wsp. 2016).
Działanie antyoksydacyjne i przeciwzapalne
Istnieją dane potwierdzające jego działanie antyoksydacyjne, a także stabilizujące błony hepatocytów oraz działanie przeciwzapalne. UDCA znacząco zapobiega uszkodzeniom hepatocytów po prowokacji nadtlenkiem wodoru lub kadmem (Mitsuyoshi i wsp. 1999).
UDCA zwiększa ilość glutationu (GSH) i białek zawierających tiol, a także poziom mRNA syntetazy γ-glutamylocysteiny, co potwierdza hepatoprotekcyjne działanie przeciw uszkodzeniom oksydacyjnym.
UDCA może wiązać się z apolarną domeną błon komórkowych, stabilizując jej strukturę i unikając solubilizacji(rozpuszczania?) lipidów, który to proces jest indukowany przez hydrofobowe kwasy żółciowe (Guldutuna i wsp. 1993).
UDCA został opisany jako ligand receptora glukokortykoidów, co może mieć związek z działaniem przeciwzapalnym (Miura i wsp. 2001) i działaniem immunomodulacyjnym (Yoshikawa i wsp. 1992).
Referencje:
- Abdelkader NF, Safar MM, Salem HA (2016) Ursodeoxycholic acid ameliorates apoptotic cascade in the rotenone model of Parkinson’s disease: modulation of mitochondrial perturbations. Mol Neurobiol 53(2):810–817Amaral JD, Viana RJ, Ramalho RM, Steer CJ, Rodrigues CM (2009) Bile acids: regulation ofapoptosis by ursodeoxycholic acid. J Lipid Res 50(9):1721–1734
- Beuers U (2006) Drug insight: mechanisms and sites of action of ursodeoxycholic acid in cholestasis. Nat Clin Pract Gastroenterol Hepatol 3(6):318–328
- Elia AE, Lalli S, Monsurro MR, Sagnelli A, Taiello AC, Reggiori B et al (2016) Tauroursodeoxycholic acid in the treatment of patients with amyotrophic lateral sclerosis. Eur J Neurol 23(1):45–52
- Fickert P, Zollner G, Fuchsbichler A, Stumptner C, Pojer C, Zenz R et al (2001) Effects of ursodeoxycholic and cholic acid feeding on hepatocellular transporter expression in mouse liver. Gastroenterology 121(1):170–183
- Guldutuna S, Zimmer G, Imhof M, Bhatti S, You T, Leuschner U (1993) Molecular aspects of membrane stabilization by ursodeoxycholate [see comment]. Gastroenterology 104 (6):1736–1744
- Mitsuyoshi H, Nakashima T, Sumida Y, Yoh T, Nakajima Y, Ishikawa H et al (1999) Ursodeoxycholic acid protects hepatocytes against oxidative injury via induction of antioxidants. Biochem Biophys Res Commun 263(2):537–542
- Miura T, Ouchida R, Yoshikawa N, Okamoto K, Makino Y, Nakamura T et al (2001) Functional modulation of the glucocorticoid receptor and suppression of NF-kappaB-dependent transcription by ursodeoxycholic acid. J Biol Chem 276(50):47371–47378
- Ozcan U, Yilmaz E, Ozcan L, Furuhashi M, Vaillancourt E, Smith RO et al (2006) Chemicalchaperones reduce ER stress and restore glucose homeostasis in a mouse model of type 2 diabetes. Science 313(5790):1137–1140
- Rodrigues CM, Ma X, Linehan-Stieers C, Fan G, Kren BT, Steer CJ (1999) Ursodeoxycholic acid prevents cytochrome c release in apoptosis by inhibiting mitochondrial membrane depolarization and channel formation. Cell Death Differ 6(9):842–854
- Rodrigues CM, Fan G, Wong PY, Kren BT, Steer CJ (1998b) Ursodeoxycholic acid may inhibit deoxycholic acid-induced apoptosis by modulating mitochondrial transmembrane potential and reactive oxygen species production. Mol Med 4(3):165–178
- Schoemaker MH, Conde de la Rosa L, Buist-Homan M, Vrenken TE, Havinga R, Poelstra K et al. (2004) Tauroursodeoxycholic acid protects rat hepatocytes from bile acid-induced apoptosis via activation of survival pathways. Hepatology 39(6):1563–1573
- Vang S, Longley K, Steer CJ, Low WC (2014) The unexpected uses of urso- and tauroursodeoxycholic acid in the treatment of non-liver diseases. Glob Adv Health Med 3(3):58–69
- Yoshikawa M, Tsujii T, Matsumura K, Yamao J, Matsumura Y, Kubo R et al (1992) Immunomodulatory effects of ursodeoxycholic acid on immune responses. Hepatology 16(2):358–364
Uszkodzenie cholangiocytów jest kluczowym zjawiskiem w chorobach cholestatycznych, przyczyniając się do rozwoju miejscowego zapalenia i włóknienia (Sato i wsp. 2019; Fabris i wsp. 2017). Wśród zjawisk związanych z uszkodzeniem cholangiocytów rozpatrywany jest bezpośredni wpływ hydrofobowych kwasów żółciowych na ich błonę komórkową, aktywacja autofagii i stymulowanie starzenia, a także wywołanie stresu retikulum endoplazmatycznego i urazów o podłożu immunologicznym (Banales i wsp. 2019; Sasaki i Nakanuma 2017).
Kilku autorów zwróciło uwagę na znaczenie wydzielania wodorowęglanów dla ochrony cholangiocytów przed niszczącym działaniem hydrofobowych kwasów żółciowych. Koncepcyjnie wydzielanie wodorowęglanów zwiększa pH żółci i determinuje przesunięcie hydrofobowych kwasów żółciowych w kierunku form zjonizowanych, zmniejszając w ten sposób ich zdolność do dyfuzji i redukując działanie cytotoksyczne (Banales i wsp. 2019). Koncepcja ta została określona jako hipoteza „żółciowego parasola wodorowęglanowego” (Hohenester i wsp. 2012; van Niekerk i wsp. 2018), która jest uważana za wadliwą w przypadku cholangiopatii, takich jak PBC (ang. primary biliary cholangitis) pierwotne zapalenie dróg żółciowych (Rodrigues i wsp. 2018). Wydzielanie wodorowęglanów w żółci jest realizowane przez AE2 (SLC4A2), które jest wyrażane w błonie szczytowej cholangiocytów i zależy od aktywnego chlorku wydzielanego przez te komórki. Warto zauważyć, że zarówno poziom informacyjnego RNA, jak i białek AE2, jak również wydzielanie wodorowęglanu w żółci są zmniejszone w PBC (Prieto i wsp. 1999). Leczenie UDCA warunkuje zwiększone wydzielanie płynów przez cholangiocyty oraz zwiększa wydzielanie wodorowęglanów w żółci (Li i wsp. 2018). Ponadto UDCA przywraca związane z cholestazą zmniejszone poziomy mRNA AE2 oraz ekspresję białek, co uważa się za ważny mechanizm działania UDCA w cholangiopatiach. Co ważne, ostatnie dowody sugerują, że rozregulowana autofagia i starzenie się cholangiocytów w PBC mogą być również związane z wadliwym parasolem wodorowęglanowym dróg żółciowych, ponieważ knockdown AE2 wywołuje właśnie te zjawiska w komórkach dróg żółciowych (Sasaki i wsp.2018).
Referencje:
- Banales JM, Huebert RC, Karlsen T, Strazzabosco M, LaRusso NF, Gores GJ (2019) Cholangiocyte pathobiology. Nat Rev Gastroenterol Hepatol. https://doi.org/10.1038/s41575- 019-0125-y
- Fabris L, Spirli C, Cadamuro M, Fiorotto R, Strazzabosco M (2017) Emerging concepts in biliary repair and fibrosis. Am J Physiol Gastrointest Liver Physiol 313(2):G102–GG16
- Hohenester S, Wenniger LM, Paulusma CC, van Vliet SJ, Jefferson DM, Elferink RP et al (2012) A biliary HCO3-umbrella constitutes a protective mechanism against bile acid-induced injury in human cholangiocytes. Hepatology 55(1):173–183
- Li Q, Dutta A, Kresge C, Bugde A, Feranchak AP (2018) Bile acids stimulate cholangiocyte fluid secretion by activation of transmembrane member 16A Cl() channels. Hepatology 68(1):187–199
- Prieto J, Garcia N, Marti-Climent JM, Penuelas I, Richter JA, Medina JF (1999) Assessment of biliary bicarbonate secretion in humans by positron emission tomography. Gastroenterology 117(1):167–172
- Sasaki M, Sato Y, Nakanuma Y (2018) An impaired biliary bicarbonate umbrella may be involved in dysregulated autophagy in primary biliary cholangitis. Lab Investig 98(6):745–754
- Sato K, Glaser S, Kennedy L, Liangpunsakul S, Meng F, Francis H et al (2019) Preclinical insights into cholangiopathies: disease modeling and emerging therapeutic targets. Expert Opin Ther Targets:1–12. https://doi.org/10.1080/14728222.2019.1608950
- van Niekerk J, Kersten R, Beuers U (2018) Role of bile acids and the biliary HCO3() umbrella inthe pathogenesis of primary biliary cholangitis. Clin Liver Dis 22(3):457–4
Kolejną bardzo istotną cechą UDCA jest jego zdolność do hamowania apoptozy. Opisano kilka mechanizmów jego działania, które mogą za to odpowiadać. Apoptoza jest fizjologicznym mechanizmem, którego celem jest usunięcie starych lub chorych komórek z organizmu. Jej zaburzenie, występujące w chorobach wątroby, prowadzi do nadmiernego niszczenia hepatocytów i komórek dróg żółciowych, co z kolei wywołuje uszkodzenia wątroby.
UDCA został opisany jako agonista receptorów glikokortykoidowych, przez co może hamować apoptozę stymulowaną przez TGF-β1.
Może też zmniejszać wpływ innych kwasów żółciowych na receptory FAS znajdujące się na powierzchni komórek.
UDCA zwiększa stabilność i zmniejsza przenikalność błon mitochondrialnych. Tym samym cytoprotekcyjne właściwości UDCA mogą wynikać z jego działania antyapoptycznego.
Jedną z ważniejszych cech UDCA jest zdolność do stabilizacji bariery chroniącej komórki wątroby. Tworzy ją warstwa glikokaliksu, w której uwięzione są jony HCO3-. Nie pozwala ona ujemnie naładowanym cząsteczkom kwasów żółciowych na przeniknięcie do wnętrza cholangio- i hepatocytów, gdzie mogą stymulować apoptozę i nekrozę. UDCA pobudza wydzielanie HCO3- przez hepatocyty i cholangiocyty, wzmacniając wyżej opisaną barierę ochronną (tzw. żółciowy parasol HCO3-). Wynika to z aktywacji wymiennika Cl-/HCO3- oraz zwiększenia ekspresji anionowego transportera 2. Zatem UDCA chroni komórki przed bezpośrednim uszkodzeniem i w konsekwencji przed śmiercią.
W chorobach cholestatycznych zwiększa się gęstość receptorów tkankowych MHC klasy I, co może narażać komórki wątroby na atak autoimmunologiczny. Podanie UDCA prowadzi do zmniejszenia ich ekspresji. UDCA reguluje też produkcję wielu immunoglobulin i cytokin produkowanych przez komórki immunokompetentne.
UDCA wzmaga wydzielanie kwasów żółciowych oraz anionów organicznych, głównie przez mechanizm potranskrypcyjny na poziomie hepatocytów. W zgodzie z tymi wynikami jest obserwowany w trakcie terapii UDCA spadek poziomu bilirubiny u pacjentów cierpiących na pierwotne żółciowe zapalenie dróg żółciowych (dawniej pierwotna marskość żółciowa, PBC - ang. primary biliary cirrhosis) i pierwotne stwardniające zapalenie dróg żółciowych (PSC - ang. primary sclerosing cholangitis). Tak więc, za poprawę wyników leczenia w tej grupie chorych może odpowiadać przyspieszony przepływ zalegających w drogach żółciowych toksycznych substancji.
In vitro na hodowlach szczurzych komórek wątrobowych wykazano, że po podaniu UDCA zwiększa się w hepatocytach zawartość metalotioneiny oraz glutationu. W innych badaniach stwierdzono, że występujące u osób leczonych UDCA zmniejszenie wpływu endogennych kwasów żółciowych na komórki Kupffera zmniejsza ilość wytwarzanych przez nie wolnych rodników tlenowych.
W badaniach eksperymentalnych stwierdzono też, że UDCA posiada właściwości antyfibrotyczne, co może wynikać z jego zdolności do hamowania fibroproliferacyjnej aktywności fibroblastów aktywowanych płytkowym czynnikiem wzrostu (PDGF - ang. platelet-derived growth factor). Należy przy tym podkreślić, że stężenia niezbędne do wywołania opisywanych powyżej efektów mogą być osiągane in vivo w drogach żółciowych.
Referencje:
- Beuers U, Trauner M, Jansen P, Poupon R (2015a) New paradigms in the treatment of hepatic cholestasis: from UDCA to FXR, PXR and beyond. J Hepatol 62(1 Suppl):S25–S37
- Dilger K, Hohenester S, Winkler-Budenhofer U, Bastiaansen BA, Schaap FG, Rust C et al (2012) Effect of ursodeoxycholic acid on bile acid profiles and intestinal detoxification machinery in primary biliary cirrhosis and health. J Hepatol 57(1):133–140
- Hofmann A (2009) Bile acids and the enterohepatic circulation. In: Arias IM (ed) The liver: biology and pathobiology. Kluwer, Boston, pp 287–304
- Marin JJ, Macias RI, Briz O, Banales JM, Monte MJ (2015) Bile acids in physiology, pathology and pharmacology. Curr Drug Metab 17(1):4–29
- Lanzini A, De Tavonatti MG, Panarotto B, Scalia S, Mora A, Benini F et al (2003) Intestinal absorption of the bile acid analogue 75Se-homocholic acid-taurine is increased in primary biliary cirrhosis, and reverts to normal during ursodeoxycholic acid administration. Gut 52(9):1371–1375
- Daniel Cabrera, Juan Pablo Arab, Marco Arrese: UDCA, NorUDCA, and TUDCA in Liver Diseases: A Review of Their Mechanisms of Action and Clinical Applications. Handbook of Experimental Pharmacology, https://doi.org/10.1007/164_2019_241
- ChPL Proursan z dnia 12.11.2013

PRO.MED.CS
Czechy Citassime simi, natae. Ovidunt occus dolorem pelenisciae. Ut dis et parciis que nihit aceat repudae vid excernatibus elis que velibus, od que magnam, vellaccus evenis ipsam fuga. Mus, omnisto reptata sperrunt. Lupit, sedisitio doloribusci dellab invel ipidunt lanist aut pe nonectem estis iducilitemutas vero dolest, que rem rehenda que cus, consequidis exerchic to mos es sim quam adic tem ilitist ut que omnieni od mollant laut remqui doles as poria ipsus, ium aut quidunt vel im atempore eos aut aut facerum doluptio vel enis
PRO.MED.PL
Citassime simi, natae. Ovidunt occus dolorem pelenisciae. Ut dis et parciis que nihit aceat repudae vid excernatibus elis que velibus, od que magnam, vellaccus evenis ipsam fuga. Mus, omnisto reptata sperrunt. Lupit, sedisitio doloribusci dellab invel ipidunt lanist aut pe nonectem estis iducilitemutas vero dolest, que rem rehenda que cus, consequidis exerchic to mos es sim quam adic tem ilitist ut que omnieni od mollant laut remqui doles as poria ipsus, ium aut quidunt vel im atempore eos aut aut facerum doluptio vel enis
PROURSAN
Citassime simi, natae. Ovidunt occus dolorem pelenisciae. Ut dis et parciis que nihit aceat repudae vid excernatibus elis que velibus, od que magnam, vellaccus evenis ipsam fuga. Mus, omnisto reptata sperrunt. Lupit, sedisitio doloribusci dellab invel ipidunt lanist aut pe nonectem estis iducilitemutas vero dolest, que rem rehenda que cus, consequidis exerchic to mos es sim quam adic tem ilitist ut que omnieni od mollant laut remqui doles as poria ipsus, ium aut quidunt vel im atempore eos aut aut facerum doluptio vel enis